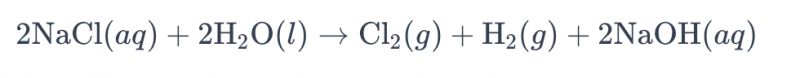Процесот на електролиза на раствор од саламура со употреба на титаниумски електроди за производство на хлор најчесто се нарекува „електролиза на саламура“. Во овој процес, се користат титаниумски електроди за да се олесни реакцијата на оксидација на хлоридните јони во саламурата, што доведува до генерирање на гас од хлор. Целокупната хемиска равенка за реакцијата е како што следува:
Во оваа равенка, хлоридните јони се оксидираат на анодата, што резултира со производство на хлорен гас, додека молекулите на водата се редуцираат на катодата, давајќи водороден гас. Дополнително, хидроксидните јони се редуцираат на анодата, формирајќи водороден гас и натриум хидроксид.
Изборот на титаниумски електроди се должи на одличната отпорност на корозија и спроводливост на титаниумот, што му овозможува стабилно да се подложи на реакцијата за време на електролизата без корозија. Ова ги прави титаниумските електроди идеален избор за електролиза на саламура.
Електролизата на солена вода обично бара надворешен извор на енергија за да се обезбеди енергија за електролитската реакција. Овој извор на енергија е обично напојување со еднонасочна струја (DC) бидејќи електролитските реакции бараат конзистентна насока на проток на струја, а напојувањето со еднонасочна струја може да испорача константна насока на струјата.
Во процесот на електролиза на солена вода за генерирање на хлорен гас, најчесто се користи нисконапонско еднонасочно напојување. Напонот на напојувањето зависи од специфичните услови на реакцијата и дизајнот на опремата, но генерално се движи помеѓу 2 и 4 волти. Дополнително, интензитетот на струјата на напојувањето е клучен параметар што треба да се одреди врз основа на големината на реакционата комора и посакуваниот принос на производство.
Накратко, изборот на напојување за електролиза на солена вода зависи од специфичните барања на експериментите или индустриските процеси за да се обезбеди ефикасна реакција и постигнување на посакуваните производи.
Време на објавување: 16 јануари 2024 година